苏州大学发表关于肿瘤微环境的文献综述!
近日,我校功能纳米与软物质研究院刘庄教授受邀在Nature系列期刊Nature Reviews Bioengineering上发表了题为“Biomaterials tools to modulate the tumour microenvironment in immunotherapy”的综述。
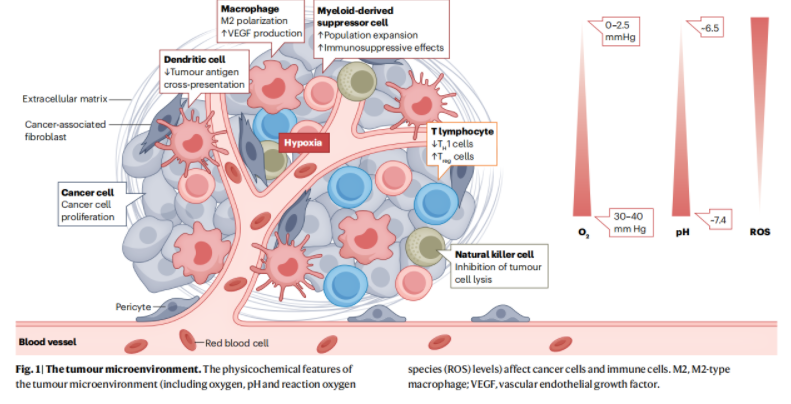
图1. 肿瘤微环境的物理化学特征(包括氧、pH值和反应氧(ROS)水平)影响癌细胞和免疫细胞
肿瘤微环境(tumor microenvironment, TME)是由肿瘤内各种类型的细胞、肿瘤血管、分泌因子和细胞外基质组成的肿瘤赖以生存的土壤。然而,肿瘤细胞旺盛的代谢需求会导致肿瘤内存在包括乏氧、酸性、高活性氧(ROS)等独特特征,这种恶劣的环境会影响促炎免疫细胞的活性,导致肿瘤免疫逃逸。另一方面,实体瘤内不规则的肿瘤血管、缺失的淋巴回流系统、以及肿瘤内升高的间质压等微环境因素,也限制了免疫细胞特别是效应T细胞对肿瘤内部的浸润。此外,免疫细胞在恶劣的肿瘤微环境下也更容易呈现抑制的免疫表型,不利于免疫系统对肿瘤细胞的识别和攻击。
近日,我校功能纳米与软物质研究院刘庄教授受邀在Nature系列期刊Nature Reviews Bioengineering上发表了题为“Biomaterials tools to modulate the tumour microenvironment in immunotherapy”的综述。在该综述中,作者首先系统介绍了实体肿瘤微环境的组成以及各种特征,主要包括肿瘤乏氧、微酸性、高水平活性氧和高间质压力等,阐明了肿瘤微环境和各种免疫细胞间的相互作用及肿瘤免疫抑制微环境产生的原理。在此基础上,他们回顾及探讨了近年来发展的一系列可调节肿瘤微环境的生物材料技术。生物材料的自身化学特性可对TME发生响应并调节其物理化学特征,生物材料也可被用于递送调节TME的效应分子。通过利用生物材料工具逆转肿瘤乏氧、中和肿瘤酸性、清除瘤内活性氧或降低肿瘤内间质压,可以促进各类炎性免疫细胞在肿瘤内的浸润,提升抗肿瘤免疫细胞的活性,从而在不增加额外副作用的前提下显著增强各类免疫疗法对肿瘤的杀伤能力。在此基础上,作者对每种技术的优势和局限性进行了深入的讨论,并分析了由技术迈向临床转化的前景。事实上,刘庄教授团队近年一直致力于该方向的基础和转化研究。刘庄教授课题组的博士后巢宇为该文的第一作者。
文章网址:https://www.nature.com//articles/s44222-022-00004-6
文章题目:Biomaterials tools to modulate the tumour microenvironment in immunotherapy
作者信息:Yu Chao & Zhuang Liu*
刘庄教授课题组网址:http://nano.suda.edu.cn/lz/main.htm
特别声明:本文转载自苏州大学,仅仅是出于传播分享信息的需要,如果作者不希望被转载,请与https://www.paperpp.com/联系!
800万大学生都在用的免费论文查重平台
本文由PaperPP论文查重系统原创,转载请注明出处:https://www.paperpp.com/news/11576 .html


